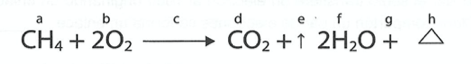Quiz Summary
0 of 42 questions completed
Questions:
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- 23
- 24
- 25
- 26
- 27
- 28
- 29
- 30
- 31
- 32
- 33
- 34
- 35
- 36
- 37
- 38
- 39
- 40
- 41
- 42
Information
You have already completed the quiz before. Hence you can not start it again.
Quiz is loading…
You must sign in or sign up to start the quiz.
You must first complete the following:
Results
Results
0 of 42 questions answered correctly
Your time:
Time has elapsed
You have reached 0 of 0 point(s), (0)
Earned Point(s): 0 of 0, (0)
0 Essay(s) Pending (Possible Point(s): 0)
Categories
- Not categorized 0%
-
Necesitas estudiar más los temas de química.
-
Todavía tienes que repasar los diferentes temas de la materia de química.
-
Aprobaste el cuestionario pero todavía puedes mejorar si estudias más los temas de química.
-
Muy bien es una buena calificación sólo te falta un poco, para tener todas perfectamente contestaras.
-
Perfecto ¡te felicito¡, contestaste bien todas las preguntas, sigue así.
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- 23
- 24
- 25
- 26
- 27
- 28
- 29
- 30
- 31
- 32
- 33
- 34
- 35
- 36
- 37
- 38
- 39
- 40
- 41
- 42
- Answered
- Review
-
Question 1 of 42
1. Question
En la reacción:
3{{H}_{2}}(g)+{{N}_{2}}+(g)\to 2N{{H}_{3}}(g)
la letra (g) indica que la sustancia es:
CorrectIncorrect -
Question 2 of 42
2. Question
CorrectIncorrect -
Question 3 of 42
3. Question
¿Cuántas moléculas existirán en 180 g de agua? Masa atómica O= 16 g H= 1.0 g
CorrectIncorrect -
Question 4 of 42
4. Question
¿Cuál es la masa molecular del H3 PO4 si la masa atómica del H=1, del P= 31 y del O =16 u.m.a.?
CorrectIncorrect -
Question 5 of 42
5. Question
Selecciona los elementos que pertenecen al grupo de los halógenos.
1. Flúor 2. Helio 3. calcio 4. cloro 5. Potasio 6. Yodo CorrectIncorrect -
Question 6 of 42
6. Question
Selección de mayor a menor cantidad, el número de moles de los siguientes elementos.
Masas molares. Na= 23 g, K= 39 g, Ca= 40 g, Li= 7g
1. 2 gramos de sodio 2. 3 gramos de potasio 3. 2 gramos de calcio 4. 1 gramos de litio CorrectIncorrect -
Question 7 of 42
7. Question
A los compuestos iónicos que en solución conducen electricidad se les llama:
CorrectIncorrect -
Question 8 of 42
8. Question
Es el ácido producido en el estómago que degrada los alimentos.
1. Ácido clorhídrico 2. Ácido sulfúrico 3. Ácido nítrico 4. Ácido fosfórico CorrectIncorrect -
Question 9 of 42
9. Question
Para comprender el enlace químico se propuso una estructura donde se representa el símbolo o la fórmula por medio de los ____________ de valencia alrededor del mismo, propuesta por __________ para indicar si el elemento cumple con la regla del octeto.
CorrectIncorrect -
Question 10 of 42
10. Question
¿Cuántos átomos en total indica la fórmula del NH4 (nitrato de amonio)?
CorrectIncorrect -
Question 11 of 42
11. Question
Cuando el potasio pierde su único electrón de Valencia se convierte en:
CorrectIncorrect -
Question 12 of 42
12. Question
Postuló la ley de la conservación de la materia.
CorrectIncorrect -
Question 13 of 42
13. Question
Una característica notable de los metales es:
CorrectIncorrect -
Question 14 of 42
14. Question
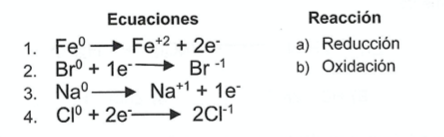
Es la pérdida de electrones en un proceso químico y la formación de sus correspondientes iones:
CorrectIncorrect -
Question 15 of 42
15. Question
Selecciona las propiedades intensivas de la materia:
1. Dureza 2.Volumen 3. Peso 4. Maleabilidad 5. Viscosidad 6. Masa CorrectIncorrect -
Question 16 of 42
16. Question
El catión Fe puede actuar como Fe2+ y Fe3+ , por lo que la fórmula correcta del óxido férrico es:
CorrectIncorrect -
Question 17 of 42
17. Question
En la combustión de un depósito de papel, la estructura interna de la materia cambia, formándose un fenómeno _______________ y si arrugamos solamente dicho papel se presenta un fenómeno _____________ por no sufrir una alteración interna de la materia.
CorrectIncorrect -
Question 18 of 42
18. Question
Una mol de H2O equivale a 18 gramos por lo que 1.5 moles de H2O equivalen a:
CorrectIncorrect -
Question 19 of 42
19. Question
Fue el creador de la Tabla Periódica de los Elementos.
1. Dalton 2. Cannizzaro 3. Mendeléyev 4. Meyer CorrectIncorrect -
Question 20 of 42
20. Question
La combustión en presencia de aire es una prueba de que en éste existe:
CorrectIncorrect -
Question 21 of 42
21. Question
En el compuesto Nal el sodio transfiere un electrón al Yodo originando un enlace__________. Cuando el Hidrógeno y el Cloro comparten un par de electrones se forma un enlace ___________ en dicho compuesto.
CorrectIncorrect -
Question 22 of 42
22. Question
Si aún metal se le aumenta la temperatura sufre____________, que es el ____________ de volumen.
CorrectIncorrect -
Question 23 of 42
23. Question
En la siguiente reacción química, la fórmula del reactivo que contiene cloro es ____________ y la del producto ___________ respectivamente.
CorrectIncorrect -
Question 24 of 42
24. Question
En la tabla periódica, la electronegatividad ______________ a lo largo de un _____________ de izquierda a derecha.
CorrectIncorrect -
Question 25 of 42
25. Question
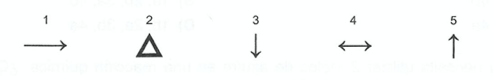
El significado de la siguiente simbología en una reacción química corresponde a:
a) Reacción reversible b) Precipitado c) Gas que se desprende d) Reacción irreversible e) Calentamiento CorrectIncorrect -
Question 26 of 42
26. Question
Los enlaces covalentes se forman cuando se ___________ electrones entre ______ para formar un compuesto químico.
CorrectIncorrect -
Question 27 of 42
27. Question
Selecciona las características de los ácidos.
1. Tienen pH menor a 7.0 2. Conducen la corriente 3. Tienen sabor amargo 4. No conducen la corriente 5. Su pH es mayor a 7.0 6. Tienen sabor agrio CorrectIncorrect -
Question 28 of 42
28. Question
Si el Bismuto tiene un número de protones (Z) = 83 y masa atómica (A) = 209, ¿cuántos neutrones tiene?
CorrectIncorrect -
Question 29 of 42
29. Question
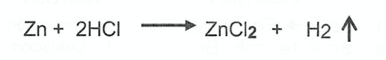
Cuándo en una ecuación química se coloca el símbolo → se refiere a una reacción:
CorrectIncorrect -
Question 30 of 42
30. Question
Clasifica las siguientes sustancias por elemento, compuesto y mezcla respectivamente.
1. Nitrógeno 2. Aire 3. Cloruro de Sodio CorrectIncorrect -
Question 31 of 42
31. Question
¿Cuál es un ejemplo de mezcla?
CorrectIncorrect -
Question 32 of 42
32. Question
Ordena los elementos químicos de mayor a menor electronegatividad.
1. Potasio 2. Sodio 3. Litio 4. Rubidio CorrectIncorrect -
Question 33 of 42
33. Question
Para contar una gran cantidad de _____________ muy pequeñas (iones, átomos o moléculas) se utiliza una unidad química llamada __________ considera también como el número de Avogadro.
CorrectIncorrect -
Question 34 of 42
34. Question
Cuándo a un tubo de ensayo que contiene oxígeno se le acerca una pajilla con un punto de ignición, este se aviva hasta convertirse en flama, lo cual significa que el oxígeno actúa como:
CorrectIncorrect -
Question 35 of 42
35. Question
Relaciona los cambios de estado de la materia con ejemplos cotidianos.
Cambios Ejemplos 1. Sublimación a) La formación de la lluvia 2. Evaporación b) Tanque de oxígeno 3. Licuefacción c) Lava volcánica 4. Condensación d) Obtener la sal del mar 5. Fusión e) Yodo elemental CorrectIncorrect -
Question 36 of 42
36. Question
Relaciona la fórmula química con el compuesto.
Fórmula Compuesto 1. HCl a) Hidróxido de sodio 2. NaOH b) Ácido clorhídrico 3. Na2O c) Óxido de sodio 4. H2SO4 d) Ácido sulfúrico CorrectIncorrect -
Question 37 of 42
37. Question
Fórmula en la que se representan seis átomos de oxígeno y 12 de hidrógeno:
CorrectIncorrect -
Question 38 of 42
38. Question
Relacionan los métodos para separar las mezclas.
Método Mezcla 1. Filtración a) Alcohol – agua 2. Centrifugación b) Sangre 3. Destilación c) Aguarrás – tierra CorrectIncorrect -
Question 39 of 42
39. Question
CorrectIncorrect -
Question 40 of 42
40. Question
¿Cuál es la fórmula del bióxido de nitrógeno?
CorrectIncorrect -
Question 41 of 42
41. Question
CorrectIncorrect -
Question 42 of 42
42. Question
Si una alumna necesita utilizar dos moles de azufre en una reacción química. ¿Cuántos gramos debe pesar en la balanza? Masa atómica S= 32 g
CorrectIncorrect